Cada vez hay más pruebas que apuntan a una relación entre esta debilitante enfermedad neurológica y los microbios que viven en nuestros intestinos. La conexión podría venir a través del nervio vago.
Puede empezar con algo pequeño: un peculiar entumecimiento, un sutil tic facial, un músculo inexplicablemente rígido. Pero luego pasa el tiempo y, finalmente, aparecen los temblores.
Aproximadamente un millón de personas en Estados Unidos (y unos 10 millones en todo el mundo) padecen la enfermedad de Parkinson, un potente trastorno neurológico que mata progresivamente las neuronas del cerebro. A medida que lo hace, puede desencadenar una serie de síntomas incapacitantes, desde violentos temblores a calambres musculares insoportables, pesadillas aterradoras y niebla cerebral constante. Aunque los tratamientos médicos pueden aliviar algunos de estos efectos, los investigadores aún no saben exactamente qué causa la enfermedad en primer lugar.
Sin embargo, un número cada vez mayor de estudios sugiere que puede estar vinculado a un culpable poco probable: las bacterias que viven dentro de nuestros intestinos.
Cada uno de nosotros tiene cientos o miles de especies microbianas en el estómago, el intestino delgado y el colon. Estas bacterias, denominadas colectivamente microbioma intestinal, suelen ser huéspedes considerados: aunque sobreviven en gran medida gracias a los alimentos que pasan por nuestro interior, también nos retribuyen, produciendo nutrientes esenciales como la niacina (que ayuda a nuestro organismo a convertir los alimentos en energía) y descomponiendo la fibra vegetal, que de otro modo sería imposible de digerir, en sustancias que nuestro cuerpo puede utilizar.
A medida que el párkinson avanza en el cerebro, los investigadores han reportado que las especies de bacterias presentes en el intestino también cambian drásticamente, lo que apunta a una posible causa de la enfermedad. Un trabajo de 2022 publicado en la revista Nature Communications registró esas diferencias en detalle. Tras secuenciar los genomas mezclados de bacterias fecales de 724 personas —un grupo con párkinson y otro sin la enfermedad—, los autores observaron una serie de cambios distintivos en los intestinos de las personas que padecían la enfermedad.
El grupo con párkinson tenía cantidades dramáticamente más bajas de ciertas especies de Prevotella, un tipo de bacteria que ayuda al cuerpo a descomponer la fibra de origen vegetal (cambios como este en la flora intestinal podrían explicar por qué las personas con enfermedad de Parkinson a menudo experimentan estreñimiento). Al mismo tiempo, el estudio encontró que proliferaron dos especies dañinas de Enterobacteriaceae, una familia de microbios que incluye a la Salmonella, E. coli y otros bichos. Esas bacterias pueden estar involucradas en una cadena de eventos bioquímicos que eventualmente matan las células cerebrales de los pacientes con párkinson, dice Tim Sampson, biólogo de la Facultad de Medicina de la Universidad Emory y coautor del estudio.
A primera vista, la relación entre las bacterias y las enfermedades cerebrales no es precisamente obvia. ¿Cómo puede un cambio en los microbios intestinales desencadenar un devastador trastorno neurodegenerativo? La relación entre ambos puede parecer contraintuitiva, pero Sampson dice que se reduce a las sutiles formas en que el cerebro y el intestino están conectados.
En las paredes intestinales, una red de neuronas denominada sistema nervioso entérico permite al organismo percibir lo que ocurre en el intestino y responder en consecuencia. Este circuito controla el movimiento muscular, el flujo sanguíneo local, la secreción de mucosidad y otras funciones digestivas esenciales.
Dado que las células del sistema nervioso entérico están incrustadas en la pared intestinal, muchas de ellas entran en estrecho contacto con el lumen —la cavidad del intestino que contiene el microbioma—, donde pueden interactuar directamente con sustancias bioquímicas creadas por las bacterias. Algunas de ellas son proteínas pegajosas llamadas curli que pueden estar implicadas en el párkinson.
En circunstancias normales, las proteínas curli permiten a las enterobacterias construir biopelículas, los tapetes pegajosos que protegen a los microbios y les ayudan a permanecer en el intestino. Sin embargo, si una molécula de curli entra en contacto con una proteína común creada por las células nerviosas —llamada alfa-sinucleína— esa proteína empieza a plegarse mal y forma una masa peligrosa llamada agregado. Una vez creados, estos agregados pueden propagarse ampliamente por el sistema nervioso, saltar de célula en célula y acabar entrando en el cerebro a través del nervio vago, la principal vía que transporta señales entre el cerebro y el intestino. Se cree que, en algunos casos de párkinson en humanos, los cambios en el microbioma intestinal pueden activar ese proceso, dice Emeran Mayer, gastroenterólogo y neurocientífico de UCLA y coautor de una reciente revisión de la conexión intestino-cerebro en el Annual Review of Medicine.
Este vídeo muestra la estructura de las fibrillas de alfa-sinucleína, partículas tóxicas implicadas en la enfermedad de Parkinson, determinada mediante criomicroscopía electrónica. CRÉDITO: R. GUERRERO-FERREIRA ET AL/eLIFELa sospecha de que el nervio vago desempeña un papel clave en las enfermedades neurodegenerativas ha ido en aumento en los últimos años. Un estudio de 2017 en la revista Neurology, señala Mayer, mostró que “si se corta el nervio vago, disminuye el riesgo de enfermedad de Parkinson. Eso es una indicación bastante fuerte de qué …este material degenerativo se transporta, aparentemente, a través del nervio vago”.
En las últimas décadas, una serie de estudios con animales han demostrado que el nervio vago proporciona un conducto físico que las moléculas pueden utilizar para moverse entre el intestino y el cerebro —pero aunque esta superautopista neurológica podría desempeñar un papel importante en el párkinson, todavía no está claro si el nervio es una pieza clave en la causa de la enfermedad en sí—.
Además de los agregados que se mueven a través del nervio vago, diferentes desencadenantes —como los lípidos, vitaminas y otros compuestos orgánicos que producen las bacterias intestinales— podrían viajar a través de los vasos sanguíneos hasta el cerebro, donde podrían causar inflamación y dañar el tejido. Del mismo modo, dice David Hafler, neuroinmunólogo de la Universidad de Yale, las células inmunitarias que se activan en el intestino podrían contribuir al daño neurológico y a la disfunción que se produce en el párkinson.
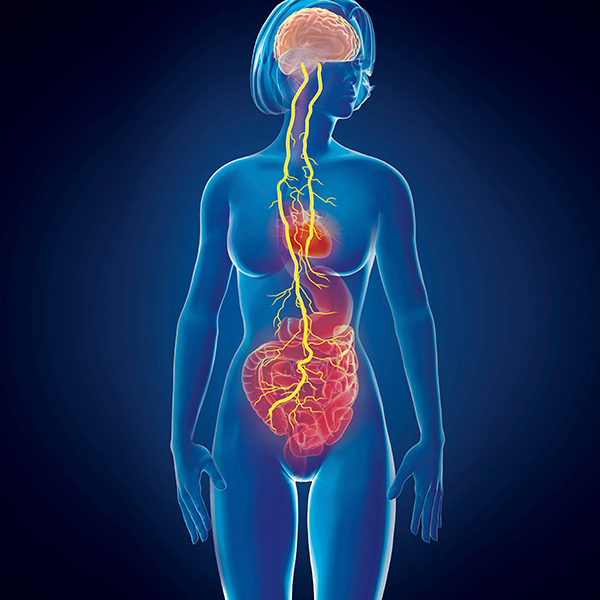
Estas células inmunitarias, llamadas células T, pueden migrar fuera del intestino, entrar en el torrente sanguíneo y cruzar la barrera hematoencefálica, donde finalmente pueden acabar con las neuronas. Este tipo de respuesta autoinmune es el motor de otras enfermedades neurológicas como la esclerosis múltiple, razona Hafler, por lo que es factible que también desempeñe un papel en el párkinson. En ambas enfermedades, los cambios en el microbioma intestinal podrían ser el desencadenante potencial.
Ya hay pruebas sólidas de esta idea. En 2016, Sampson halló una conexión directa entre los microbios intestinales y la enfermedad de Parkinson: utilizando muestras fecales de pacientes con párkinson, Sampson inoculó los intestinos de ratones libres de gérmenes (animales sin microbioma natural), y los animales desarrollaron rápidamente los síntomas del párkinson. Hoy en día, utilizando el nuevo estudio genético de los microbios intestinales que él y sus colegas publicaron en Nature Communications, junto a sus colegas, Sampson está enfocándose en unas pocas familias de microbios y utilizando métodos similares para revelar qué especies precisas son las culpables.
El enfoque de Sampson viene con algunas advertencias: la enfermedad de Parkinson, después de todo, podría estar vinculada a múltiples bacterias que interactúan de manera compleja, por lo que es probable que no haya una única responsable. Tampoco está totalmente claro si los cambios en el microbioma son la causa principal o si simplemente aceleran el daño que ya se está produciendo en el cerebro. La complejidad del microbioma es alucinante: hay cientos de tipos diferentes de bacterias, y cada una de ellas crea una miríada de moléculas que afectan a la digestión, el sistema inmunitario y otras funciones corporales importantes. Clasificar todos esos componentes e identificar cómo cambian frente a la enfermedad será un importante siguiente paso.
Y así, por muy tentadores que puedan ser los vínculos entre el microbioma y el párkinson, podrían pasar décadas antes de que las personas que padecen el trastorno puedan obtener algún beneficio tangible. Muchos de los investigadores que examinan esos vínculos, como Mayer, también advierten a los pacientes que desconfíen de las afirmaciones generalizadas sobre medicamentos, suplementos o incluso trasplantes fecales —sembrar el intestino con microbios de otra persona sana— que “tratan” el párkinson alterando el microbioma.
“Mucha gente gana mucho dinero vendiendo suplementos individuales, diciéndote que van a ralentizar tu deterioro cognitivo o a prevenir la enfermedad de Parkinson”, dice Mayer. Pero, añade, “no sabemos con seguridad el papel causal del microbioma. Lo que sabemos es por estudios con animales, así que tenemos pruebas indirectas de ello, pero ha sido difícil demostrar en humanos sin lugar a duda que los microbios, y algunas de sus señales moleculares, desempeñan el principal papel causal”.
Hasta que se encuentren respuestas definitivas, investigadores como Mayer seguirán tratando de resolver el problema, microbio por microbio.




